Cardiaque
Recherche et développement.
Vous souhaitez connaître les effets de votre molécule, extrait ou composé sur l’activité électrique ou contractile cardiaque?
Vous souhaitez caractériser l’activité électrique ou contractile cardiaque de votre modèle transgénique?
Nous vous proposons une série de tests complémentaires in vitro, ex vivo et in vivo qui vous apporteront des réponses.
Pharmacologie de sécurité.
Vous souhaitez réaliser une évaluation préclinique des effets de votre molécule sur la repolarisation cardiaque ?
Exploration in vivo
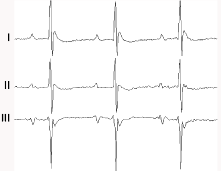
- Electrocardiogramme
- Exploration endocavitaire par cathétérisme
Animaux anesthésiés
Ce test couple une mesure non invasive (électrocardiogramme de surface) et invasive (intracardiaque) de l’activité électrique cardiaque spontanée ou en réponse à une stimulation électrique programmée à l’aide de cathéters (1.3 F à 2 F) placés dans le cœur droit via la veine jugulaire.
Paramètres mesurés : intervalles AH et HV, périodes réfractaires auriculaire, auriculo-ventriculaire et ventriculaire, conduction sino-atriale… L’induction d’arythmies atriales ou ventriculaires peut être réalisée.
Cette technique peut également être utilisée pour produire des modèles animaux de bloc auriculo-ventriculaire complet par ablation du faisceau de His par radiofréquence.
Formation possible sur demande
- Echocardiographie-Doppler
|
Animaux anesthésiés (Vevo 3100, Fujifilm) Acquisition Biogenouest – IBiSA – FEDER |
 |
Etude morphologique et fonctionnelle du cœur et des vaisseaux.
Pour les examens cardiaques, caractérisation précise de la morphologie de chaque section cardiaque, d’évaluer le débit, la perfusion et la contractilité régionale par « speckle tracking » et « tissue Doppler imaging », et d’acquérir le volume cardiaque en 4D, comme cela est fait chez l’homme. Ces approches sont indispensables à la caractérisation fine des modèles de troubles de la conduction et d’insuffisance cardiaque.
Etude des valvulopathies: évaluation précise de la morphologie (épaisseur, mouvement d’ouverture et fermeture, etc.) et de la fonction (quantification de la sévérité de la pathologie, évaluation des flux transvalvulaires par Doppler couleur, etc.) des valves
Exploration ex vivo
- Cœur isolé travaillant
|
Cette technique permet de faire des mesures d’hémodynamie sur des cœurs ex vivo en recréant un circuit normal de contraction cardiaque sans avoir d’interposition du système nerveux autonome.Les effets de drogues, l’hypoxie ou un débalancement ionique peuvent être étudiés. Une modification des paramètres de précharge et post charge peut simuler un mauvais retour veineux ou une hypertension artérielle, respectivement. Paramètres mesurés: fréquence cardiaque, pression ventriculaire gauche pic (DP), taux maximal d’augmentation de la pression pendant la contraction (dP/dt max), taux maximal de la diminution de la pression au cours de la relaxation (dP/dt min), débit cardiaque, ECG… Formation possible sur demande |
- Mesure de contraction de tissus myocardiques isolés
Ce test vise à évaluer les effets directs des composés pharmacologiques sur la contractilité des préparations multicellulaires cardiaques isolées. Les muscles papillaires excisés sont placés dans une chambre, perfusés avec une solution physiologique oxygénée et stimulés à un taux constant. Les contractions sont enregistrées avec un capteur de force.
Paramètres mesurés: amplitude et durée de contraction, temps de contraction (vitesse de contraction) et le temps de relaxation (vitesse de relaxation).
Exploration in vitro
-
Enregistrement de potentiels de surface par la technique des MultiElectrode Arrays (MEA) sur des cardiomyocytes
ventriculaires de souris ou de rat nouveau-nés en culture primaire et sur des cardiomyocytes différenciés à partir de cellules souches pluripotentes induites humaines.
-
Enregistrement de potentiels d’action par la technique des microélectrodes intracellulaires sur tissus isolés
perfusés : myocarde auriculaire et ventriculaire (souris, rat).
- Enregistrement de potentiels d’action par une technique de fluorescence à haut débit (plaque 96 puits) sur des
cardiomyocytes ventriculaires de souris ou de rat nouveau-nés en culture primaire et sur des cardiomyocytes différenciés à partir de cellules souches pluripotentes induites humaines (CellOptic® – Fond FEDER)
- Enregistrement de potentiels d’action et courants ioniques de cardiomyocytes isolés (souris, rat) par la technique de patch-clamp
- Caractérisation fonctionnelle par la technique de patch-clamp de canaux ioniques sur lignées cellulaires transfectées
stables et transitoires [Nav1.5, Cav1.2, Kv7.1 (KvLQT1), Kv11.1 (ERG), Kir2.1, Kir6.2, HCN2...]
- Mesure de raccourcissements de cardiomyocytes isolés (souris, rat)
- Mesure de raccourcissements de sarcomères
 chaton chaton |
 |
||
Modèles animaux:
- Choc endotoxemique
Modèle animal : rat
Méthode : injection intraveineuse de lipopolysaccharides d’Escherichia coli.
Ce modèle peut être étudié entre 3h-24 h post-injection.
- Choc septique
Modèle animal : rat et souris
Méthode : ligature ponction caecale
Ce modèle peut être étudié entre 12h-48 h post induction.
- Insuffisance cardiaque d’origine ischémique
Modèle animal : rat
Méthode : ligature artère coronaire gauche
Ce modèle peut être étudié durant la phase aiguë de l’infarctus ou plus tardivement, jusqu’à 12 semaines post-ligature, avec 2 niveaux d’insuffisance cardiaque, compensée ou décompensée.
- Troubles progressifs de la conduction cardiaque
Modèle animal : souris invalidée (knock-out), à l’état hétérozygote, pour le gène Scn5a qui code le canal sodique Nav1.5.
Ce modèle présente le phénotype (troubles progressifs de la conduction cardiaque associée à l’apparition de fibrose) des patients atteints de la maladie de Lenègre, l’une des principales causes d’implantation de stimulateurs cardiaques.
- Syndrome du QT long de type 3
Modèle animal : souris mutée (Knock-in), à l’état hétérozygote, sur le gène Scn5a qui code le canal Nav1.5.
La mutation induit une forme sévère du QT long avec des arythmies ventriculaires spontanées et, secondairement, une cardiomyopathie dilatée.